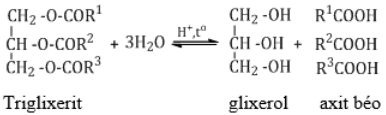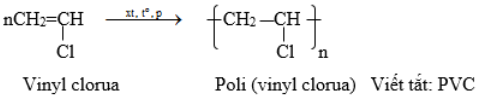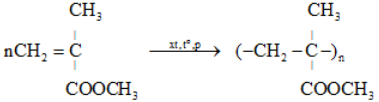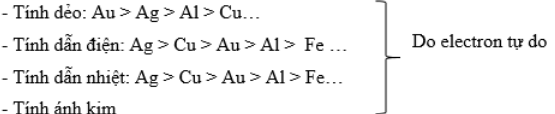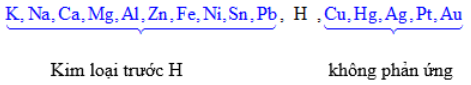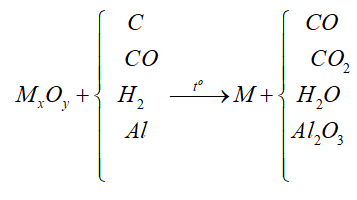- Đề thi học kì 1 môn hoá lớp 12 năm 2019 - 2020 sở giáo dục Tây Ninh
- Đề thi học kì 1 môn hoá lớp 12 năm 2019 - 2020 sở giáo dục Bình Thuận
- Giải đề thi học kì 1 hoá lớp 12 năm 2019 - 2020 sở giáo dục và đào tạo Đà Nẵng
- Đề thi học kì 1 môn hoá lớp 12 năm 2018 - 2019 chuyên Vinh
- Đề thi học kì 1 môn hoá lớp 12 năm 2019 - 2020 sở giáo dục Hà Nam
- Giải đề thi học kì I Hóa học 12 sở giáo dục Thừa Thiên Huế có đáp án và lời giải chi tiết
- Đề thi học kì 1 môn hoá lớp 12 năm 2019 - 2020 trường Chu Văn An Hà Nội
- Giải đề thi hết học kì I Hóa 12 năm học 2020 - 2021 sở GDĐT Bắc Ninh có đáp án và lời giải chi tiết
- Giải đề thi học kì I Hóa học 12 trường THPT Nguyễn Siêu Hà Nội có đáp án và lời giải chi tiết
- Đề cương ôn tập học kỳ I môn hóa lớp 12
- Giải đề thi hết học kì I Hóa học 12 Sở GDĐT Bến Tre có đáp án và lời giải chi tiết
- Đề cương bài tập ôn tập học I Hóa học 12 có đáp án và lời giải chi tiết
- Đề kiểm tra 15 phút - Đề số 1 - Chương 4 - Hóa học 12
- Đề kiểm tra 15 phút – Đề số 2– Chương 4 – Hóa học 12
- Đề kiểm tra 15 phút – Đề số 3 – Chương 3,4 – Hóa học 12
- Đề số 1 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 2 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 3 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 4 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 5 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 6 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 7 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 8 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 9 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 10 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 11 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 12 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 13 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 14 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 15 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 16 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 18 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 17 - Đề kiểm tra học kì 1 - Hóa học 12
![ảnh môn học Vật lí]() Vật lí
Vật lí
- SBT Vật lí Lớp 11
- Bài giảng ôn luyện kiến thức môn Vật lí lớp 11
- SGK Vật lí 11 - Chân trời sáng tạo
- Chuyên đề học tập Vật lí 11 - Chân trời sáng tạo
- SBT Vật lí 11 - Cánh Diều
- SGK Vật lí 11 - Cánh Diều
- SBT Vật lí 11 - Chân trời sáng tạo
- Tổng hợp Lí thuyết Vật lí 11
- SBT Vật lí 11 - Kết nối tri thức với cuộc sống
- SGK Vật lí 11 - Kết nối tri thức với cuộc sống
- Chuyên đề học tập Vật lí 11 - Kết nối tri thức với cuộc sống
- Chuyên đề học tập Vật lí 11 - Cánh Diều
- SGK Vật lí Nâng cao Lớp 11
- SGK Vật lí Lớp 11
![ảnh môn học Tiếng Anh]() Tiếng Anh
Tiếng Anh
- SBT Tiếng Anh Lớp 11 mới
- Đề thi, đề kiểm tra Tiếng Anh 11 mới
- SHS Tiếng Anh 11 - Explore New Worlds
- SBT Tiếng Anh 11 - Explore New Worlds
- SBT Tiếng Anh 11 - i-Learn Smart World
- SHS Tiếng Anh 11 - English Discovery
- SBT Tiếng Anh 11 - Global Success
- SHS Tiếng Anh 11 - Bright
- SBT Tiếng Anh 11 - Friends Global
- SHS Tiếng Anh 11 - i-Learn Smart World
- SHS Tiếng Anh 11 - Global Success
- SHS Tiếng Anh 11 - Friends Global
- SBT Tiếng Anh 11 - Bright
- SBT Tiếng Anh 11 - English Discovery
- Bài giảng ôn luyện kiến thức môn Tiếng Anh lớp 11
- Tổng hợp Lí thuyết Tiếng Anh 11
- SGK Tiếng Anh Lớp 11 mới
- SGK Tiếng Anh Lớp 11
![ảnh môn học Sinh học]() Sinh học
Sinh học
- SBT Sinh Lớp 11
- SGK Sinh học 11 - Cánh Diều
- SBT Sinh học 11 - Cánh Diều
- SBT Sinh học 11 - Kết nối tri thức với cuộc sống
- SBT Sinh học 11 - Chân trời sáng tạo
- Chuyên đề học tập Sinh học 11 - Cánh Diều
- Chuyên đề học tập Sinh học 11 - Chân trời sáng tạo
- Chuyên đề học tập Sinh học 11 - Kết nối tri thức với cuộc sống
- Tổng hợp Lí thuyết Sinh học 11
- SGK Sinh học 11 - Kết nối tri thức với cuộc sống
- SGK Sinh học 11 - Chân trời sáng tạo
- Bài giảng ôn luyện kiến thức môn Sinh học lớp 11
- SGK Sinh Nâng cao Lớp 11
- SGK Sinh Lớp 11
![ảnh môn học Địa lí]() Địa lí
Địa lí
- SGK Địa lí Lớp 11
- SGK Địa lí 11 - Chân trời sáng tạo
- SBT Địa lí 11 - Chân trời sáng tạo
- Chuyên đề học tập Địa lí 11 - Chân trời sáng tạo
- Tổng hợp Lí thuyết Địa lí 11
- SGK Địa lí 11 - Cánh Diều
- SBT Địa lí 11 - Kết nối tri thức với cuộc sống
- Chuyên đề học tập Địa lí 11 - Kết nối tri thức với cuộc sống
- Chuyên đề học tập Địa lí 11 - Cánh Diều
- SBT Địa lí 11 - Cánh Diều
- SGK Địa lí 11 - Kết nối tri thức với cuộc sống
- Bài giảng ôn luyện kiến thức môn Địa lí lớp 11
- SBT Địa lí Lớp 11
- Tập bản đồ Địa lí Lớp 11
![ảnh môn học Công nghệ]() Công nghệ
Công nghệ
- SGK Công nghệ Lớp 11
- SGK Công nghệ 11 - Phần Cơ khí - Cánh Diều
- SGK Công nghệ 11 - Phần Cơ khí - Chân trời sáng tạo
- SGK Công nghệ 11 - Phần Chăn nuôi - Cánh Diều
- SGK Công nghệ 11 - Phần Cơ khí - Kết nối tri thức với cuộc sống
- SGK Công nghệ 11 - Phần Chăn nuôi - Kết nối tri thức với cuộc sống
- SGK Công nghệ 11 - Phần Chăn nuôi - Chân trời sáng tạo
![ảnh môn học Hóa học]() Hóa học
Hóa học
- SGK Hóa học Nâng cao Lớp 11
- Bài giảng ôn luyện kiến thức môn Hóa học lớp 11
- SBT Hóa học 11 - Kết nối tri thức với cuộc sống
- SBT Hóa học 11 - Cánh Diều
- Chuyên đề học tập Hóa học 11 - Cánh Diều
- SGK Hóa học 11 - Kết nối tri thức với cuộc sống
- SGK Hóa học 11 - Cánh Diều
- Tổng hợp Lí thuyết Hóa học 11
- SGK Hóa học 11 - Chân trời sáng tạo
- Chuyên đề học tập Hóa học 11 - Kết nối tri thức với cuộc sống
- SBT Hóa học 11 - Chân trời sáng tạo
- Chuyên đề học tập Hóa học 11 - Chân trời sáng tạo
- SGK Hóa Lớp 11
- SBT Hóa Lớp 11
![ảnh môn học Ngữ văn]() Ngữ văn
Ngữ văn
- Soạn văn chi tiết Lớp 11
- SBT Ngữ văn 11 - Chân trời sáng tạo
- Chuyên đề học tập Ngữ văn 11 - Chân trời sáng tạo
- SBT Ngữ văn 11 - Cánh Diều
- Tuyển tập những bài văn hay Ngữ văn 11 - Chân trời sáng tạo
- SGK Ngữ văn 11 - Cánh Diều
- Chuyên đề học tập Ngữ văn 11 - Kết nối tri thức với cuộc sống
- SGK Ngữ văn 11 - Kết nối tri thức với cuộc sống
- Tuyển tập những bài văn hay Ngữ văn 11 - Cánh Diều
- Bài giảng ôn luyện kiến thức môn Ngữ Văn lớp 11
- SBT Ngữ văn 11 - Kết nối tri thức với cuộc sống
- SGK Ngữ văn 11 - Chân trời sáng tạo
- Chuyên đề học tập Ngữ văn 11 - Cánh Diều
- Tuyển tập những bài văn hay Ngữ văn 11 - Kết nối tri thức với cuộc sống
- Soạn văn siêu ngắn Lớp 11
- Tác giả - Tác phẩm Lớp 11
- Văn mẫu Lớp 11
![ảnh môn học Toán học]() Toán học
Toán học
- SBT Toán Nâng cao Lớp 11
- Chuyên đề học tập Toán 11 - Chân trời sáng tạo
- Chuyên đề học tập Toán 11 - Kết nối tri thức với cuộc sống
- SGK Toán 11 - Kết nối tri thức với cuộc sống
- SBT Toán 11 - Chân trời sáng tạo
- Chuyên đề học tập Toán 11 - Cánh Diều
- SBT Toán 11 - Cánh Diều
- SBT Toán 11 - Kết nối tri thức với cuộc sống
- SGK Toán 11 - Chân trời sáng tạo
- SGK Toán 11 - Cánh Diều
- Tổng hợp Lí thuyết Toán 11
- Bài giảng ôn luyện kiến thức môn Toán lớp 11
- SBT Toán Lớp 11
- SGK Toán Nâng cao Lớp 11
- SGK Toán Lớp 11
![ảnh môn học Lịch sử]() Lịch sử
Lịch sử
- SGK Lịch sử Lớp 11
- SGK Lịch sử 11 - Kết nối tri thức với cuộc sống
- Chuyên đề học tập Lịch sử 11 - Cánh Diều
- SBT Lịch sử 11 - Cánh Diều
- SBT Lịch sử 11 - Kết nối tri thức với cuộc sống
- SGK Lịch sử 11 - Chân trời sáng tạo
- Chuyên đề học tập Lịch sử 11 - Chân trời sáng tạo
- SGK Lịch sử 11 - Cánh Diều
- Bài giảng ôn luyện kiến thức môn Lịch sử lớp 11
- SBT Lịch sử 11 - Chân trời sáng tạo
- Tổng hợp Lí thuyết Lịch sử 11
- Chuyên đề học tập Lịch sử 11 - Kết nối tri thức với cuộc sống
- SBT Lịch sử Lớp 11
- Tập bản đồ Lịch sử Lớp 11
![ảnh môn học Giáo dục kinh tế và pháp luật]() Giáo dục kinh tế và pháp luật
Giáo dục kinh tế và pháp luật
- SGK Giáo dục Kinh tế và Pháp luật 11 - Cánh Diều
- Bài giảng ôn luyện kiến thức môn Giáo dục kinh tế và pháp luật lớp 11
- SBT Giáo dục Kinh tế và Pháp luật 11 - Chân trời sáng tạo
- Chuyên đề học tập Giáo dục Kinh tế và Pháp luật 11 - Cánh Diều
- SGK Giáo dục Kinh tế và Pháp luật 11 - Kết nối tri thức với cuộc sống
- Chuyên đề học tập Giáo dục Kinh tế và Pháp luật 11 - Chân trời sáng tạo
- Chuyên đề học tập Giáo dục Kinh tế và Pháp luật 11 - Kết nối tri thức với cuộc sống
- SGK Giáo dục Kinh tế và Pháp luật 11 - Chân trời sáng tạo
- SBT Giáo dục Kinh tế và Pháp luật 11 - Kết nối tri thức với cuộc sống
- Tổng hợp Lí thuyết Giáo dục Kinh tế và Pháp luật 11
- SBT Giáo dục Kinh tế và Pháp luật 11 - Cánh Diều
![ảnh môn học Giáo dục thể chất]() Giáo dục thể chất
Giáo dục thể chất
- SGK Giáo dục thể chất - Đá cầu - Cánh Diều
- SGK Giáo dục thể chất - Kiến thức chung - Cánh Diều
- SGK Giáo dục thể chất - Bóng chuyền - Kết nối tri thức với cuộc sống
- SGK Giáo dục thể chất - Bóng đá - Chân trời sáng tạo
- SGK Giáo dục thể chất - Bóng rổ - Kết nối tri thức với cuộc sống
- SGK Giáo dục thể chất - Bóng đá - Cánh Diều
- SGK Giáo dục thể chất - Cầu lông - Chân trời sáng tạo
- SGK Giáo dục thể chất - Bóng chuyền - Chân trời sáng tạo
- SGK Giáo dục thể chất - Bóng đá - Kết nối tri thức với cuộc sống
- SGK Giáo dục thể chất - Cầu lông - Kết nối tri thức với cuộc sống
- SGK Giáo dục thể chất - Bóng chuyền - Cánh Diều
- SGK Giáo dục thể chất - Bóng rổ - Cánh Diều
- SGK Giáo dục thể chất - Cầu lông - Cánh Diều
- SGK Giáo dục thể chất - Bóng rổ - Chân trời sáng tạo
![ảnh môn học Tiếng Anh]() Tiếng Anh
Tiếng Anh
- Lý thuyết Tiếng Anh Lớp 10
- Đề thi, đề kiểm tra Tiếng Anh - Bright
- Đề thi, đề kiểm tra Tiếng Anh - iLearn Smart World
- Đề thi, đề kiểm tra Tiếng Anh - Global Success
- Đề thi, đề kiểm tra Tiếng Anh - English Discovery
- Đề thi, đề kiểm tra Tiếng Anh - Friends Global
- Bài giảng ôn luyện kiến thức môn Tiếng Anh lớp 10
- SBT Bright Lớp 10
- SBT English Discovery Lớp 10
- SBT Friends Global Lớp 10
- SBT Global Success Lớp 10
- SBT iLearn Smart World Lớp 10
- Tiếng Anh - Bright Lớp 10
- Tiếng Anh - English Discovery Lớp 10
- Tiếng Anh - Explore New Worlds Lớp 10
- Tiếng Anh - Friends Global Lớp 10
- Tiếng Anh - Global Success Lớp 10
- Tiếng Anh - iLearn Smart World Lớp 10
![ảnh môn học Lịch sử]() Lịch sử
Lịch sử
- Chuyên đề học tập Lịch sử - Kết nối tri thức Lớp 10
- Đề thi, kiểm tra Lịch sử lớp 10
- SBT Lịch sử - Cánh diều 10
- Bài giảng ôn luyện kiến thức môn Lịch sử lớp 10
- SBT Lịch sử 10 - Chân trời sáng tạo Lớp 10
- SBT Lịch sử - Kết nối tri thức Lớp 10
- SGK Lịch sử - Cánh Diều Lớp 10
- SGK Lịch sử - Chân trời sáng tạo Lớp 10
- SGK Lịch sử - Kết nối tri thức Lớp 10
![ảnh môn học Toán học]() Toán học
Toán học
- Chuyên đề học tập Toán - Cánh diều Lớp 10
- Đề thi, đề kiểm tra Toán lớp 10 - Kết nối tri thức
- Đề thi, đề kiểm tra Toán lớp 10 - Chân trời sáng tạo
- Đề thi, đề kiểm tra Toán lớp 10 - Cánh diều
- Bài giảng ôn luyện kiến thức môn Toán lớp 10
- Chuyên đề học tập Toán - Chân trời sáng tạo Lớp 10
- Chuyên đề học tập Toán - Kết nối tri thức Lớp 10
- Lý thuyết Toán Lớp 10
- SBT Toán - Cánh Diều Lớp 10
- SBT Toán - Chân trời sáng tạo Lớp 10
- SBT Toán - Kết nối tri thức Lớp 10
- SGK Toán - Cánh diều Lớp 10
- SGK Toán - Chân trời sáng tạo Lớp 10
- SGK Toán - Kết nối tri thức Lớp 10
![ảnh môn học Ngữ văn]() Ngữ văn
Ngữ văn
- Chuyên đề học tập Văn - Cánh diều Lớp 10
- Đề thi, đề kiểm tra Ngữ văn - Kết nối tri thức lớp 10
- Đề thi, đề kiểm tra Ngữ văn - Cánh diều lớp 10
- Văn mẫu - Cánh diều Lớp 10
- Văn mẫu - Kết nối tri thức
- Đề thi, đề kiểm tra Ngữ văn - Chân trời sáng tạo lớp 10
- Văn mẫu - Chân trời sáng tạo
- Bài giảng ôn luyện kiến thức môn Ngữ Văn lớp 10
- Chuyên đề học tập Văn - Chân trời sáng tạo Lớp 10
- Chuyên đề học tập Văn - Kết nối tri thức Lớp 10
- Lý thuyết Văn Lớp 10
- SBT Văn - Cánh diều Lớp 10
- SBT Văn - Chân trời sáng tạo Lớp 10
- SBT Văn - Kết nối tri thức Lớp 10
- Soạn văn - Cánh Diều - chi tiết Lớp 10
- Soạn văn - Cánh Diều - siêu ngắn Lớp 10
- Soạn văn - Chân trời sáng tạo - chi tiết Lớp 10
- Soạn văn - Chân trời sáng tạo - siêu ngắn Lớp 10
- Soạn văn - Kết nối tri thức - chi tiết Lớp 10
- Soạn văn - Kết nối tri thức - siêu ngắn Lớp 10
- Tác giả tác phẩm Lớp 10
![ảnh môn học Sinh học]() Sinh học
Sinh học
- Chuyên đề học tập Sinh - Chân trời sáng tạo Lớp 10
- Đề thi, kiểm tra Sinh - Kết nối tri thức
- Đề thi, đề kiểm tra Sinh học 10
- Đề thi, kiểm tra Sinh - Cánh diều
- Đề thi, kiểm tra Sinh - Chân trời sáng tạo
- Bài giảng ôn luyện kiến thức môn Sinh học lớp 10
- Chuyên đề học tập Sinh - Kết nối tri thức Lớp 10
- Lý thuyết Sinh Lớp 10
- SBT Sinh - Cánh diều Lớp 10
- SBT Sinh - Chân trời sáng tạo Lớp 10
- SBT Sinh - Kết nối tri thức Lớp 10
- SGK Sinh - Cánh diều Lớp 10
- SGK Sinh - Chân trời sáng tạo Lớp 10
- SGK Sinh - Kết nối tri thức Lớp 10
![ảnh môn học Hóa học]() Hóa học
Hóa học
- Chuyên đề học tập Hóa - Chân trời sáng tạo Lớp 10
- Đề thi, đề kiểm tra Hóa lớp 10 – Cánh diều
- Đề thi, đề kiểm tra Hóa lớp 10 – Kết nối tri thức
- Đề thi, đề kiểm tra Hóa lớp 10 – Chân trời sáng tạo
- Bài giảng ôn luyện kiến thức môn Hóa học lớp 10
- Chuyên đề học tập Hóa - Kết nối tri thức Lớp 10
- SBT Hóa 10 - Cánh diều Lớp 10
- SBT Hóa - Chân trời sáng tạo Lớp 10
- SBT Hóa - Kết nối tri thức Lớp 10
- SGK Hóa - Cánh diều Lớp 10
- SGK Hóa - Chân trời sáng tạo Lớp 10
- SGK Hóa - Kết nối tri thức Lớp 10
- Chuyên đề học tập Hóa - Cánh diều Lớp 10
![ảnh môn học Tiếng Anh]() Tiếng Anh
Tiếng Anh
- SGK Tiếng Anh Lớp 8 mới
- Đề thi, đề kiểm tra Tiếng Anh 8 mới
- SHS Tiếng Anh 8 - Global Success
- SHS Tiếng Anh 8 - Explore English
- SBT Tiếng Anh 8 - Global Success
- SBT Tiếng Anh 8 - THiNK
- Bài giảng ôn luyện kiến thức môn Tiếng Anh lớp 8
- SBT Tiếng Anh 8 - Macmillan Motivate
- SBT Tiếng Anh 8 - Right on!
- SBT Tiếng Anh 8 - Explore English
- SBT Tiếng Anh 8 - English Discovery
- SBTTiếng Anh 8 - i-Learn Smart World
- SBT Tiếng Anh 8 - Friends Plus
- SGK Tiếng Anh Lớp 8
- SBT Tiếng Anh Lớp 8 mới
- Vở bài tập Tiếng Anh Lớp 8
![ảnh môn học GDCD]() GDCD
GDCD
- Bài tập tình huống GDCD Lớp 8
- SBT Giáo dục công dân 8 - Kết nối tri thức với cuộc sống
- SGK Giáo dục công dân 8 - Chân trời sáng tạo
- SGK Giáo dục công dân 8 - Kết nối tri thức với cuộc sống
- SBT Giáo dục công dân 8 - Chân trời sáng tạo
- Tổng hợp Lí thuyết Giáo dục công dân 8
- SGK Giáo dục công dân 8 - Cánh Diều
- SBT Giáo dục công dân 8 - Cánh Diều
- Bài giảng ôn luyện kiến thức môn Giáo dục công dân lớp 8
- SGK GDCD Lớp 8
![ảnh môn học Ngữ văn]() Ngữ văn
Ngữ văn
- Soạn văn siêu ngắn Lớp 8
- Tuyển tập những bài văn hay Ngữ văn 8 - Chân trời sáng tạo
- SBT Ngữ văn 8 - Chân trời sáng tạo
- Tuyển tập những bài văn hay Ngữ văn 8 - Kết nối tri thức với cuộc sống
- SBT Ngữ văn 8 - Kết nối tri thức với cuộc sống
- SGK Ngữ văn 8 - Cánh Diều
- VBT Ngữ văn 8 - Kết nối tri thức với cuộc sống
- Bài giảng ôn luyện kiến thức môn Ngữ Văn lớp 8
- Tổng hợp Lí thuyết Ngữ văn 8
- SGK Ngữ văn 8 - Kết nối tri thức với cuộc sống
- Tuyển tập những bài văn hay Ngữ văn 8 - Cánh Diều
- SGK Ngữ văn 8 - Chân trời sáng tạo
- SBT Ngữ văn 8 - Cánh Diều
- Soạn văn chi tiết Lớp 8
- Tác giả - Tác phẩm văn Lớp 8
- Văn mẫu Lớp 8
- Vở bài tập Ngữ văn Lớp 8
![ảnh môn học Toán học]() Toán học
Toán học
- SGK Toán Lớp 8
- SGK Toán 8 - Chân trời sáng tạo
- SBT Toán 8 - Cánh Diều
- Bài giảng ôn luyện kiến thức môn Toán lớp 8
- SGK Toán 8 - Cánh Diều
- VBT Toán 8 - Kết nối tri thức với cuộc sống
- SBT Toán 8 - Kết nối tri thức với cuộc sống
- SGK Toán 8 - Kết nối tri thức với cuộc sống
- Tổng hợp Lí thuyết Toán 8
- SBT Toán Lớp 8
- Giải bài tập Toán Lớp 8
- Tài liệu Dạy - học Toán Lớp 8
- Đề thi, đề kiểm tra Toán Lớp 8
![ảnh môn học Lịch sử và Địa lí]() Lịch sử và Địa lí
Lịch sử và Địa lí
- Bài giảng ôn luyện kiến thức môn Địa lí lớp 8
- SGK Lịch sử và Địa lí 8 - Chân trời sáng tạo
- SBT Lịch sử và Địa lí 8 - Chân trời sáng tạo
- SBT Lịch sử và Địa lí 8 - Kết nối tri thức với cuộc sống
- SGK Lịch sử và Địa lí 8 - Cánh Diều
- SBT Lịch sử và Địa lí 8 - Cánh Diều
- SGK Lịch sử và Địa lí 8 - Kết nối tri thức với cuộc sống 1
- Tổng hợp Lí thuyết Lịch sử và Địa lí 8
- Bài giảng ôn luyện kiến thức môn Lịch sử lớp 8
![ảnh môn học Khoa học tự nhiên]() Khoa học tự nhiên
Khoa học tự nhiên
- SGK Khoa học tự nhiên 8 - Kết nối tri thức với cuộc sống
- SGK Khoa học tự nhiên 8 - Cánh Diều
- SBT Khoa học tự nhiên 8 - Chân trời sáng tạo
- SGK Khoa học tự nhiên 8 - Chân trời sáng tạo
- SBT Khoa học tự nhiên 8 - Cánh Diều
- Bài giảng ôn luyện kiến thức môn Khoa học tự nhiên lớp 8
- Tổng hợp Lí thuyết Khoa học tự nhiên 8
- SBT Khoa học tự nhiên 8 - Kết nối tri thức với cuộc sống
![ảnh môn học Khoa học tự nhiên]() Khoa học tự nhiên
Khoa học tự nhiên
- Lý thuyết Khoa học tự nhiên Lớp 7
- Đề thi, đề kiểm tra KHTN - Kết nối tri thức
- Đề thi, đề kiểm tra KHTN - Chân trời sáng tạo
- Đề thi, đề kiểm tra KHTN - Cánh Diều
- Bài giảng ôn luyện kiến thức môn Khoa học tự nhiên lớp 7
- SBT KHTN - Cánh diều Lớp 7
- SBT KHTN - Chân trời sáng tạo Lớp 7
- SBT KHTN - Kết nối tri thức Lớp 7
- SGK Khoa học tự nhiên - Cánh diều Lớp 7
- SGK Khoa học tự nhiên - Chân trời sáng tạo Lớp 7
- SGK Khoa học tự nhiên - Kết nối tri thức Lớp 7
- Vở thực hành Khoa học tự nhiên Lớp 7
![ảnh môn học Tiếng Anh]() Tiếng Anh
Tiếng Anh
- Lý thuyết Tiếng Anh Lớp 7
- Đề thi, đề kiểm tra Tiếng Anh - Right on!
- Đề thi, đề kiểm tra Tiếng Anh - English Discovery
- Bài giảng ôn luyện kiến thức môn Tiếng Anh lớp 7
- SBT English Discovery Lớp 7
- SBT Friends Plus Lớp 7
- SBT Global Success Lớp 7
- SBT iLearn Smart World Lớp 7
- SBT Right on! Lớp 7
- Tiếng Anh - English Discovery Lớp 7
- Tiếng Anh - Friends Plus Lớp 7
- Tiếng Anh - iLearn Smart World Lớp 7
- Tiếng Anh - Right on! Lớp 7
- Tiếng Anh - Global Success Lớp 7
- Đề thi, đề kiểm tra Tiếng Anh - Friends Plus
- Đề thi, đề kiểm tra Tiếng Anh - Global Success
- Đề thi, đề kiểm tra Tiếng Anh - iLearn Smart World
![ảnh môn học Lịch sử và Địa lí]() Lịch sử và Địa lí
Lịch sử và Địa lí
- SBT Lịch sử và Địa lí - Chân trời sáng tạo Lớp 7
- SBT Lịch sử và Địa lí - Cánh diều lớp 7
- Bài giảng ôn luyện kiến thức môn Địa lí lớp 7
- Bài giảng ôn luyện kiến thức môn Lịch sử lớp 7
- SBT Lịch sử và Địa lí - Kết nối tri thức Lớp 7
- SGK Lịch sử và Địa lí - Cánh Diều Lớp 7
- SGK Lịch sử và Địa lí - Chân trời sáng tạo Lớp 7
- SGK Lịch sử và Địa lí - Kết nối tri thức Lớp 7
![ảnh môn học Ngữ văn]() Ngữ văn
Ngữ văn
- Đề thi, đề kiểm tra Văn - Cánh diều Lớp 7
- Bài tập trắc nghiệm Văn 7 - Kết nối tri thức
- Bài tập trắc nghiệm Văn 7 - Cánh diều
- Bài tập trắc nghiệm Văn 7 - Chân trời sáng tạo
- Bài giảng ôn luyện kiến thức môn Ngữ Văn lớp 7
- Đề thi, đề kiểm tra Văn - Chân trời sáng tạo Lớp 7
- Đề thi, đề kiểm tra Văn - Kết nối tri thức Lớp 7
- Lý thuyết Văn Lớp 7
- SBT Văn - Cánh diều Lớp 7
- SBT Văn - Chân trời sáng tạo Lớp 7
- SBT Văn - Kết nối tri thức Lớp 7
- Soạn văn chi tiết - Cánh diều Lớp 7
- Soạn văn siêu ngắn - Cánh diều Lớp 7
- Soạn văn chi tiết - CTST Lớp 7
- Soạn văn siêu ngắn - CTST Lớp 7
- Soạn văn chi tiết - KNTT Lớp 7
- Soạn văn siêu ngắn - KNTT Lớp 7
- Tác giả - Tác phẩm văn Lớp 7
- Văn mẫu - Cánh Diều Lớp 7
- Văn mẫu - Chân trời sáng tạo Lớp 7
- Văn mẫu - Kết nối tri thức Lớp 7
- Vở thực hành văn Lớp 7
![ảnh môn học Toán học]() Toán học
Toán học
- Đề thi, đề kiểm tra Toán - Chân trời sáng tạo Lớp 7
- Bài tập trắc nghiệm Toán - Kết nối tri thức
- Đề thi, đề kiểm tra Toán - Cánh diều Lớp 7
- Bài tập trắc nghiệm Toán - Cánh diều
- Đề thi, đề kiểm tra Toán - Kết nối tri thức Lớp 7
- Bài tập trắc nghiệm Toán - Chân trời sáng tạo
- Bài giảng ôn luyện kiến thức môn Toán lớp 7
- Lý thuyết Toán Lớp 7
- SBT Toán - Cánh diều Lớp 7
- SBT Toán - Chân trời sáng tạo Lớp 7
- SBT Toán - Kết nối tri thức Lớp 7
- SGK Toán - Cánh diều Lớp 7
- SGK Toán - Chân trời sáng tạo Lớp 7
- SGK Toán - Kết nối tri thức Lớp 7
- Tài liệu Dạy - học Toán Lớp 7
- Vở thực hành Toán Lớp 7
![ảnh môn học Tiếng Anh]() Tiếng Anh
Tiếng Anh
- Ôn tập hè Tiếng Anh lớp 6
- Bài tập trắc nghiệm Tiếng Anh - iLearn Smart World
- Bài tập trắc nghiệm Tiếng Anh 6 - English Discovery
- Bài tập trắc nghiệm Tiếng Anh - Friends Plus
- Bài tập trắc nghiệm Tiếng Anh - Global Success
- Bài tập trắc nghiệm Tiếng Anh - Right on!
- SBT Global Success Lớp 6
- SBT English Discovery Lớp 6
- SBT Friends Plus Lớp 6
- SBT iLearn Smart World Lớp 6
- SBT Right on! Lớp 6
- Tiếng Anh - Explore English Lớp 6
- Tiếng Anh - Friends plus Lớp 6
- Tiếng Anh - English Discovery Lớp 6
- Global Success (Pearson) Lớp 6
- Tiếng Anh - iLearn Smart World Lớp 6
- Tiếng Anh - Right on Lớp 6
- Đề thi, đề kiểm tra Tiếng Anh - English Discovery
- Đề thi, đề kiểm tra Tiếng Anh - Friends Plus
- Đề thi, đề kiểm tra Tiếng Anh - iLearn Smart World
- Đề thi, đề kiểm tra Tiếng Anh - Global Success
- Đề thi, đề kiểm tra Tiếng Anh - Right on!
![ảnh môn học Khoa học tự nhiên]() Khoa học tự nhiên
Khoa học tự nhiên
- SGK KHTN - Cánh Diều Lớp 6
- Đề thi, đề kiểm tra KHTN - Kết nối tri thức
- Đề thi, đề kiểm tra KHTN - Chân trời sáng tạo
- Đề thi, đề kiểm tra KHTN - Cánh diều
- Bài giảng ôn luyện kiến thức môn Khoa học tự nhiên lớp 6
- SGK KHTN - Chân trời sáng tạo Lớp 6
- SGK KHTN - Kết nối tri thức Lớp 6
- SBT KHTN - Cánh Diều Lớp 6
- SBT KHTN - Chân trời sáng tạo Lớp 6
- SBT KHTN - Kết nối tri thức Lớp 6
- Vở thực hành Khoa học tự nhiên Lớp 6
![ảnh môn học HĐ trải nghiệm, hướng nghiệp]() HĐ trải nghiệm, hướng nghiệp
HĐ trải nghiệm, hướng nghiệp
- SGK Trải nghiệm, hướng nghiệp - Cánh diều Lớp 6
- SGK Trải nghiệm, hướng nghiệp - Chân trời sáng tạo Lớp 6
- SGK Trải nghiệm, hướng nghiệp - Kết nối tri thức Lớp 6
- SBT Trải nghiệm, hướng nghiệp - Chân trời sáng tạo Lớp 6
- SBT Trải nghiệm, hướng nghiệp - Kết nối tri thức Lớp 6
- Thực hành Trải nghiệm, hướng nghiệp - Cánh diều Lớp 6
![ảnh môn học Lịch sử và Địa lí]() Lịch sử và Địa lí
Lịch sử và Địa lí
- SGK Lịch sử và Địa lí - Cánh Diều Lớp 6
- Đề thi, kiểm tra Lịch sử và Địa lí - Kết nối tri thức
- Đề thi, kiểm tra Lịch sử và Địa lí - Cánh Diều
- Đề thi, kiểm tra Lịch sử và Địa lí - Chân trời sáng tạo
- Bài giảng ôn luyện kiến thức môn Địa lí lớp 6
- Bài giảng ôn luyện kiến thức môn Lịch sử lớp 6
- SGK Lịch sử và Địa lí - CTST Lớp 6
- SGK Lịch sử và Địa lí - KNTT Lớp 6
- SBT Lịch sử và Địa lí - KNTT Lớp 6
- SBT Lịch sử và Địa lí - Cánh diều Lớp 6
- SBT Lịch sử và Địa lí - CTST Lớp 6
![ảnh môn học Ngữ văn]() Ngữ văn
Ngữ văn
- Đề thi, đề kiểm tra Văn - Cánh diều Lớp 6
- Bài tập trắc nghiệm Văn - Kết nối tri thức
- Bài tập trắc nghiệm Văn - Chân trời sáng tạo
- Đề thi, đề kiểm tra Văn - Kết nối tri thức
- Bài tập trắc nghiệm Văn - Cánh diều
- Bài giảng ôn luyện kiến thức môn Ngữ Văn lớp 6
- Đề thi, đề kiểm tra Văn - Chân trời sáng tạo Lớp 6
- Đề thi, đề kiểm tra Văn - Kết nối tri thức Lớp 6
- SBT Văn - Chân trời sáng tạo Lớp 6
- Ôn tập hè Văn Lớp 6
- SBT Văn - Cánh diều Lớp 6
- SBT Văn - Kết nối tri thức Lớp 6
- Soạn văn chi tiết - Cánh diều Lớp 6
- Soạn văn siêu ngắn - Cánh diều Lớp 6
- Soạn văn chi tiết - CTST Lớp 6
- Soạn văn siêu ngắn - CTST Lớp 6
- Soạn văn chi tiết - KNTT Lớp 6
- Soạn văn siêu ngắn - KNTT Lớp 6
- Tác giả - Tác phẩm văn Lớp 6
- Văn mẫu - Cánh Diều Lớp 6
- Văn mẫu - Kết nối tri thức Lớp 6
- Văn mẫu - Chân trời sáng tạo Lớp 6
- Vở thực hành văn Lớp 6
![ảnh môn học Toán học]() Toán học
Toán học
- Ôn tập hè Toán Lớp 6
- Bài tập trắc nghiệm Toán - Cánh diều
- Bài tập trắc nghiệm Toán - Kết nối tri thức
- Bài tập trắc nghiệm Toán 6 - Chân trời sáng tạo
- Bài giảng ôn luyện kiến thức môn Toán lớp 6
- SBT Toán - Cánh diều Lớp 6
- SBT Toán - Kết nối tri thức Lớp 6
- SBT Toán - Chân trời sáng tạo Lớp 6
- Tài liệu Dạy - học Toán Lớp 6
- SGK Toán - Cánh diều Lớp 6
- SGK Toán - Chân trời sáng tạo Lớp 6
- SGK Toán - Kết nối tri thức Lớp 6
- Đề thi, đề kiểm tra Toán - Cánh diều
- Đề thi, đề kiểm tra Toán - Chân trời sáng tạo
- Đề thi, đề kiểm tra Toán - Kết nối tri thức
- Vở thực hành Toán Lớp 6
![ảnh môn học Toán học]() Toán học
Toán học
- SGK Toán Lớp 5
- Bài tập trắc nghiệm Toán 5
- Công thức Toán lớp 5
- Toán nâng cao lớp 5
- Bài giảng ôn luyện kiến thức môn Toán lớp 5
- Kết nối tri thức
- VNEN Toán Lớp 5
- Vở bài tập Toán Lớp 5
- Bài tập cuối tuần Toán Lớp 5
- Cùng em học toán Lớp 5
- Đề thi, đề kiểm tra Toán Lớp 5
- Bài tập phát triển năng lực Toán Lớp 5
![ảnh môn học Lịch sử và Địa lí]() Lịch sử và Địa lí
Lịch sử và Địa lí
- SGK Lịch sử và Địa lí Lớp 4
- SGK Lịch sử và Địa lí 4 - Cánh Diều
- VBT Lịch sử và Địa lí 4 - Chân trời sáng tạo
- SGK Lịch sử và Địa lí 4 - Kết nối tri thức với cuộc sống
- VBT Lịch sử và Địa lí 4 - Cánh Diều
- SGK Lịch sử và Địa lí 4 - Chân trời sáng tạo
- VBT Lịch sử và Địa lí 4 - Kết nối tri thức với cuộc sống
- Vở bài tập Lịch sử Lớp 4
- Vở bài tập Địa lí Lớp 4
![ảnh môn học Toán học]() Toán học
Toán học
- SGK Toán Lớp 4
- SGK Toán 4 - Kết nối tri thức với cuộc sống
- STK - Cùng em phát triển năng lực Toán 4
- Bài giảng ôn luyện kiến thức môn Toán lớp 4
- SGK Toán 4 - Chân trời sáng tạo
- SGK Toán 4 - Cánh Diều
- VBT Toán 4 - Chân trời sáng tạo
- VBT Toán 4 - Kết nối tri thức với cuộc sống
- VBT Toán 4 - Cánh Diều
- VNEN Toán Lớp 4
- Vở bài tập Toán Lớp 4
- Bài tập cuối tuần Toán Lớp 4
- Cùng em học toán Lớp 4
- Ôn tập hè Toán Lớp 4
- Đề thi, đề kiểm tra Toán Lớp 4
- Bài tập phát triển năng lực Toán Lớp 4
![ảnh môn học Tiếng việt]() Tiếng việt
Tiếng việt
- SGK Tiếng Việt Lớp 4
- VBT Tiếng Việt 4 - Cánh Diều
- SGK Tiếng Việt 4 - Chân trời sáng tạo
- VBT Tiếng Việt 4 - Chân trời sáng tạo
- SGK Tiếng Việt 4 - Kết nối tri thức với cuộc sống
- VBT Tiếng Việt 4 - Kết nối tri thức với cuộc sống
- SGK Tiếng Việt 4 - Cánh Diều
- Bài giảng ôn luyện kiến thức môn Tiếng Việt lớp 4
- Cùng em học Tiếng Việt Lớp 4
- VNEN Tiếng Việt Lớp 4
- Vở bài tập Tiếng Việt Lớp 4
- Văn mẫu Lớp 4
- Đề thi, đề kiểm tra Tiếng Việt Lớp 4
- Ôn tập hè Tiếng Việt Lớp 4
![ảnh môn học Tiếng Anh]() Tiếng Anh
Tiếng Anh
- SGK Tiếng Anh Lớp 4 Mới
- Đề thi, đề kiểm tra Tiếng Anh lớp 4
- SHS Tiếng Anh 4 - Family and Friends
- SHS Tiếng Anh 4 - i-Learn Smart Start
- SBT Tiếng Anh 4 - Explore Our World
- Bài giảng ôn luyện kiến thức môn Tiếng Anh lớp 4
- SBT Tiếng Anh 4 - i-Learn Smart Start
- SHS Tiếng Anh 4 - Phonics-Smart
- SBT Tiếng Anh 4 - Global Success
- SHS Tiếng Anh 4 - Explore Our World
- SBT Tiếng Anh 4 - Phonics-Smart
- SHS Tiếng Anh 4 - Global Success
- SBT Tiếng Anh 4 - Family and Friends
- SBT Tiếng Anh Lớp 4
- Ôn tập hè Tiếng Anh Lớp 4
![ảnh môn học Toán học]() Toán học
Toán học
- Bài tập cuối tuần môn Toán Lớp 3
- Bài tập trắc nghiệm Toán - Kết nối tri thức
- Đề thi, đề kiểm tra Toán - Chân trời sáng tạo
- Bài tập trắc nghiệm Toán - Chân trời sáng tạo
- Bài tập trắc nghiệm Toán - Cánh diều
- Đề thi, đề kiểm tra Toán - Kết nối tri thức
- Đề thi, đề kiểm tra Toán - Cánh diều
- Bài giảng ôn luyện kiến thức môn Toán lớp 3
- Cùng em học Toán Lớp 3
- SGK Toán - Cánh diều Lớp 3
- SGK Toán - Chân trời sáng tạo Lớp 3
- SGK Toán - Kết nối tri thức Lớp 3
- VBT Toán - Kết nối tri thức Lớp 3
![ảnh môn học Tiếng việt]() Tiếng việt
Tiếng việt
- Cùng em học Tiếng Việt Lớp 3
- VBT Tiếng Việt - Cánh diều Lớp 3
- Đề thi, đề kiểm tra Tiếng Việt 3
- Bài giảng ôn luyện kiến thức môn Tiếng Việt lớp 3
- Tiếng Việt - Cánh diều Lớp 3
- Tiếng Việt - Chân trời sáng tạo Lớp 3
- Tiếng Việt - Kết nối tri thức Lớp 3
- Văn mẫu - Kết nối tri thức Lớp 3
- Văn mẫu Lớp 3
- VBT Tiếng Việt - Chân trời sáng tạo Lớp 3
- VBT Tiếng Việt - Kết nối tri thức Lớp 3
![ảnh môn học Tiếng Anh]() Tiếng Anh
Tiếng Anh
- Bài tập trắc nghiệm Tiếng Anh - Family and Friends
- Đề thi, đề kiểm tra Tiếng Anh - Family and Friends Lớp 3
- Bài tập trắc nghiệm Tiếng Anh - iLearn Smart Start
- Bài tập trắc nghiệm Tiếng Anh - Global Success
- Bài giảng ôn luyện kiến thức môn Tiếng Anh lớp 3
- Đề thi, đề kiểm tra Tiếng Anh - Global Success Lớp 3
- Đề thi, đề kiểm tra Tiếng Anh - iLearn Smart Start Lớp 3
- SBT Tiếng Anh - Family and Friends Lớp 3
- SBT Tiếng Anh - iLearn Smart Start Lớp 3
- SBT Tiếng Anh - Global Success Lớp 3
- SBT Tiếng Anh - Phonics Smart Lớp 3
- Tiếng Anh 3 - Explore Our World Lớp 3
- Tiếng Anh - Family and Friends Lớp 3
- Đề thi, đề kiểm tra Tiếng Anh - Explore Our World
- Tiếng Anh - Global Success Lớp 3
- Tiếng Anh - iLearn Smart Start Lớp 3
- Đề thi, đề kiểm tra Tiếng Anh - Phonics Smart
- Tiếng Anh 3 - Phonics Smart Lớp 3
![ảnh môn học Tiếng việt]() Tiếng việt
Tiếng việt
- Tiếng Việt - Kết nối tri thức Lớp 2
- Bài giảng ôn luyện kiến thức môn Tiếng Việt lớp 2
- Tiếng Việt - Chân trời sáng tạo Lớp 2
- Tiếng Việt - Cánh Diều Lớp 2
- Văn mẫu - Kết nối tri thức Lớp 2
- Văn mẫu - Chân trời sáng tạo Lớp 2
- Văn mẫu - Cánh diều Lớp 2
- VBT Tiếng Việt - Kết nối tri thức Lớp 2
- VBT Tiếng Việt - Chân trời sáng tạo Lớp 2
- VBT Tiếng Việt - Cánh diều Lớp 2
- Cùng em học Tiếng Việt Lớp 2
![ảnh môn học Tiếng Anh]() Tiếng Anh
Tiếng Anh
- Tiếng Anh - Kết nối tri thức Lớp 2
- Đề thi, đề kiểm tra Tiếng Anh - Global Success
- Đề thi, đề kiểm tra Tiếng Anh - iLearn Smart Start
- Đề thi, đề kiểm tra Tiếng Anh - Phonics Smart
- Đề thi, đề kiểm tra Tiếng Anh - English Discovery
- Đề thi, đề kiểm tra Tiếng Anh - Family and Friends
- Bài giảng ôn luyện kiến thức môn Tiếng Anh lớp 2
- Tiếng Anh - Family and Friends Lớp 2
- Tiếng Anh - iLearn Smart Start Lớp 2
- Tiếng Anh - Phonics Smart Lớp 2
- Tiếng Anh - English Discovery Lớp 2
- Tiếng Anh - Explore Our World Lớp 2
- Family & Friends Special Grade Lớp 2
- SBT Kết nối tri thức Lớp 2
- SBT Family and Friends Lớp 2
- SBT iLearn Smart Start Lớp 2
- SBT Phonics Smart Lớp 2
- SBT English Discovery Lớp 2
- SBT Explore Our World Lớp 2
![ảnh môn học Toán học]() Toán học
Toán học
- SGK Toán - Kết nối tri thức Lớp 2
- Bài tập trắc nghiệm Toán - Kết nối tri thức
- Bài tập trắc nghiệm Toán - Cánh diều
- Đề thi, đề kiểm tra Toán - Chân trời sáng tạo
- Đề thi, đề kiểm tra Toán - Kết nối tri thức
- Đề thi, đề kiểm tra Toán - Cánh diều
- Bài tập trắc nghiệm Toán - Chân trời sáng tạo
- Bài giảng ôn luyện kiến thức môn Toán lớp 2
- SGK Toán - Chân trời sáng tạo Lớp 2
- SGK Toán - Cánh Diều Lớp 2
- VBT Toán - KNTT Lớp 2
- VBT Toán - CTST Lớp 2
- Cùng em học Toán 2
- Bài tập cuối tuần Toán Lớp 2
Đề cương ôn tập học kỳ I môn hóa lớp 12
ÔN TẬP HỌC KÌ I
CHƯƠNG 1: ETSE - LIPIT
A. ESTE
I. ĐỊNH NGHĨA
- Khi thay thế nhóm OH ở nhóm COOH của axit bằng gốc OR ta thu được este
* Công thức tổng quát
+ Este được tạo bởi axit cacboxylic no, đơn chức mạch hở và ancol no, đơn chức, mạch hở (este no, đơn chức, mạch hở): CmH2m+1COOCm’H2m’+1 hay CnH2nO2 (m ≥ 0; m’ ≥ 1; n ≥ 2 ).
+ Este đa chức được tạo bởi axit cacboxylic đa chức và ancol đơn chức: R(COOR’)n
+ Este đa chức được tạo bởi axit cacboxylic đơn chức và ancol đa chức: (RCOO)nR’
+ Este đa chức được tạo bởi axit cacboxylic đa chức và ancol đa chức (cùng có n nhóm chức): R(COO)nR’
+ Tóm lại, có thể đặt CTTQ của este : CxHyOz (x, z ≥ 2; y là số chẵn, y ≤ 2x)
II. DANH PHÁP
Tên gốc hiđrocacbon R’ + tên anion gốc axit (đuôi “at”)
HCOOC2H5: etyl fomat
CH3COOCH=CH2: vinyl axetat
III. TÍNH CHẤT VẬT LÝ:
- Nhiệt độ sôi thấp hơn axit, ancol vì không tạo liên kết hiđro
- Thường: lỏng, nhẹ hơn nước, ít tan trong nước
- Hòa tan nhiều hợp chất hữu cơ
- Thường có mùi thơm dễ chịu: isoamyl axetat: mùi chuối chín; etyl butirat: mùi dứa, etyl isovalerat: mùi táo
IV. TÍNH CHẤT HÓA HỌC
1. Thủy phân môi trường axit (thuận nghịch)
R-COO-R’ + H-OH \(\overset{{{H}_{2}}S{{O}_{4}},{{t}^{{}^\circ }}}{\mathop{\leftrightarrows }}\,\)R-COOH + R’-OH
2. Thủy phân môi trường kiềm ( phản ứng xà phòng hóa)
R-COO-R’ + NaOH \(\xrightarrow{{{H}_{2}}O,{{t}^{{}^\circ }}}\)R-COONa + R’-OH
a) Tạo ancol:
CH3COOCH3 + NaOH → CH3COONa + CH3OH
b) Tạo anđehit:
RCOOCH=CH-R’ + NaOH → RCOONa + R’-CH2CH=O
c) Tạo xeton :
RCOOC(R’)=CH-R” + NaOH → RCOONa + R’-CO-CH2R”
d) Tạo phenolat:
RCOOC6H4R’ + 2NaOH → RCOONa + R’-C6H5ONa + H2O
3. Phản ứng tráng bạc của HCOOR
HCOOR + 2AgNO3 + 3NH3 + H2O → ROCOONH4 + 2Ag↓ + 2NH4NO3
V. ĐIỀU CHẾ:
1. Este của ancol (phản ứng este hóa)
\(C{{H}_{3}}COOH+{{(C{{H}_{3}})}_{2}}CHC{{H}_{2}}C{{H}_{2}}OH\overset{{{H}_{2}}S{{O}_{4}},{{t}^{o}}}{\mathop{\leftrightarrows }}\,C{{H}_{3}}COOC{{H}_{2}}C{{H}_{2}}CH{{(C{{H}_{3}})}_{2}}+{{H}_{2}}O\) Ancol isoamylic Isoamyl axetat
VI. ỨNG DỤNG:
- Dung môi hữu cơ
- Trùng hợp vinyl axetat: chất dẻo hoặc thủy phân tạo poli(vinyl ancol)
- Trùng hợp metyl acrylat; metyl metacrylat: Thủy tinh hữu cơ
- Este có mùi thơm: Công nghiệp thực phẩm, mĩ phẩm
B. LIPIT
I. ĐỊNH NGHĨA
Lipit: Hợp chất hữu cơ có trong tế bào sống, không tan trong nước nhưng tan trong dung môi hữu cơ không phân cực như ete, xăng dầu…
Chất béo (triglixerit hay triaxyl glixerol) là trieste của glixerol với axit béo
Axit béo: axit monoaxitcacboxylic có số C chẵn từ 12C ÷ 24C, không phân nhánh
+ No: axit panmitic (C15H31COOH; k = 1);
axit stearic (C17H35COOH; k = 1)
+ Không no: axit oleic (C17H33COOH; k = 2);
axit linoleic (C17H31COOH; k = 3)
II. TÍNH CHẤT VẬT LÝ
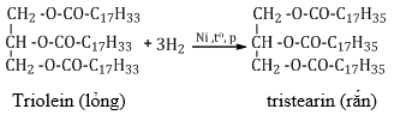
- Triglixerit chứa chủ yếu gốc axit béo no: rắn như mỡ động vật
- Triglixerit chứa chủ yếu gốc axit béo không no (dầu) : lỏng
- Chất béo: Nhẹ hơn nước, không tan trong nước, tan trong các dung môi hữu cơ như benzen, xăng, ete
III. TÍNH CHẤT HÓA HỌC
a. Thủy phân trong môi trường axit
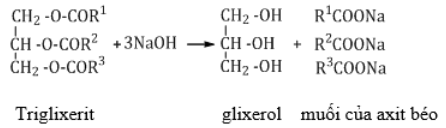
b. Thủy phân trong môi trường kiềm (phản ứng xà phòng hóa)
c. Phản ứng hiđro hóa
* Phương pháp giải
- BTKL: m xà phòng+ m glixerol = m chất béo + m NaOH
- Số trieste tối đa tạo bởi glixerol và n gốc axit béo: \(\frac{{{n}^{2}}(n+1)}{2}\)
- Xà phòng hóa chất béo bằng NaOH (KOH):
nchất béo = nglixerol = 1/3.nNaOH
- Hiệu suất \(H%=\frac{{{m}_{thuc.te}}}{{{m}_{lythuyet}}}.100%\)
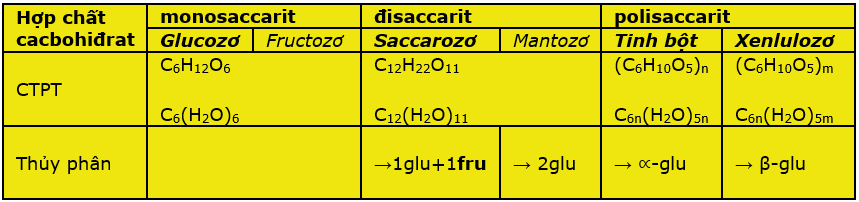
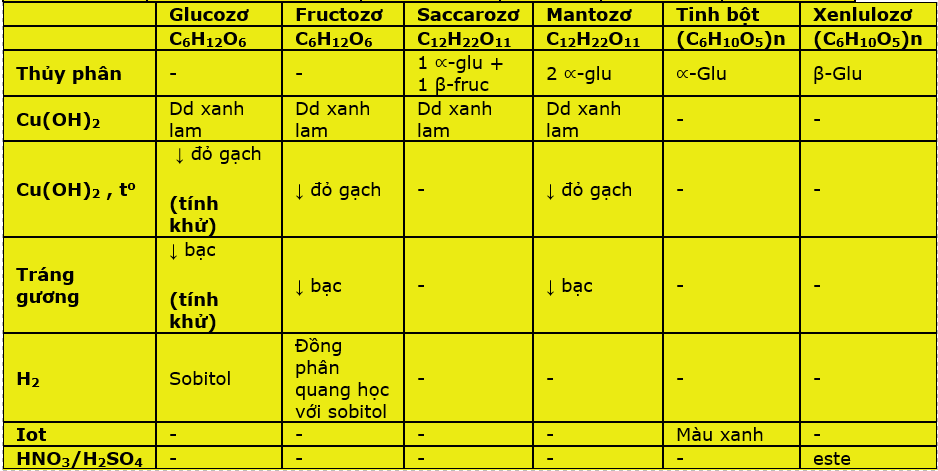
CHƯƠNG 2: CACBOHIDRAT
* Cacbohiđrat là những hợp chất hữu cơ tạp chức và thường có công thức chung là Cn(H2O)m
I. GLUCOZƠ : C6H12O6
1. Tính chất vật lý và trạng thái tự nhiên:
- Glucozơ là chất rắn, kết tinh không màu, dễ tan trong nước và có vị ngọt.
- Glucozơ có trong hầu hết các bộ phận của cây: lá, hoa, rễ, quả,… có trong cơ thể người và động vật (trong máu người chiếm 0,1%).
2. Cấu tạo phân tử:
* Cơ sở thực nghiệm xác định CTPT Glucozơ :
- Glucozơ + dd AgNO3/NH3 và dd Brom => Glucozơ có chứa nhóm CH=O.
- Glucozơ + Cu(OH)2 => Glucozơ có chứa nhiều nhóm –OH liền kề nhau.
- Glucozơ tạo este chứa 5 gốc axetat => Glucozơ chứa 5 nhóm –OH
- Khử hoàn toàn Glucozơ cho hexan => Glucozơ chứa mạch 6C không phân nhánh.
* Kết luận: Glucozơ là hợp chất tạp chức, mạch hở, ptử có chứa một nhóm CH=O và 5 nhóm OH liền kề nhau
\(\overset{6}{\mathop{C}}\,{{H}_{2}}OH-\overset{5}{\mathop{C}}\,HOH-\overset{4}{\mathop{C}}\,HOH-\overset{3}{\mathop{C}}\,HOH-\overset{2}{\mathop{C}}\,HOH-\overset{1}{\mathop{C}}\,H=O\) hay CH2OH[CHOH]4CH=O
3. Tính chất hóa học:
a. Tính chất của ancol đa chức:
- Tác dụng với Cu(OH)2:
2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu + 2H2O
dd xanh lam (phức)
- Phản ứng tạo este:
Glucozơ + (CH3CO)2O → este chứa 5 gốc axit axetic
b. Tính chất của anđehit :
- Oxi hóa glucozơ bằng dd AgNO3/NH3:
HOCH2[CHOH]4CH=O + 2AgNO3 + 3NH3 + H2O → HOCH2[CHOH]4COONH4 +2Ag↓ + 2NH4NO3
- Oxi hóa glucozơ bằng Cu(OH)2, to.
HOCH2[CHOH]4CH=O + 2Cu(OH)2 + NaOH \(\xrightarrow{{{t}^{o}}}\) HOCH2[CHOH]4COONa + Cu2O↓(đỏ gạch) + 3H2O
- Tác dụng với dung dịch Br2
HOCH2[CHOH]4CH=O + Br2 + H2O → HOCH2[CHOH]4COOH + HBr
- Khử glucozơ bằng hiđro:
HOCH2[CHOH]4CH=O + H2 \(\xrightarrow{Ni,{{t}^{o}}}\) HOCH2[CHOH]4CH2OH (sobitol)
c. Phản ứng lên men
C6H12O6 \(\xrightarrow{enzim,30-{{35}^{o}}C}\) 2C2H5OH + 2CO2
* Glucozơ là hợp chất vừa thể hiện tính chất của ancol đa chức và vừa thể hiện tính chất của andehit.
4. Điều chế và ứng dụng:
a. Điều chế: Thủy phân tinh bột.
(C6H10O5)n + nH2O \(\xrightarrow{{{H}^{+}},{{t}^{o}}}\) nC6H12O6
b. Ứng dụng: làm thức ăn quan trọng của con người, dùng cho phản ứng tráng gương và điều chế ancol etylic.
II. FRUCTOZƠ : C6H12O6
CH2OH-CHOH-CHOH-CHOH-CO-CH2OH
- Lý tính: chất kết tinh, dễ tan trong nước, có vị ngọt,...
- Hóa tính:
+ td với Cu(OH)2 (tạo dd phức màu xanh lam)
+ cộng H2 (tạo poliancol)
+ Trong môi trường bazơ fructozơ chuyển thành glucozơ, nên fructozơ cũng cho được pứ với AgNO3/NH3 hay Cu(OH)2, to.
Fructozơ \(\overset{O{{H}^{-}}}{\mathop{\leftrightarrows }}\,\) Glucozơ
* Để phân biệt giữa glucozơ và fructozơ ta dùng dd brom vì glucozơ làm mất màu dd brom
III. SACCAROZƠ : C12H22O11
- Là loại đường phổ biến nhất, có trong nhiều loài thực vật, có nhiều nhất trong cây mía, củ cải đường và hoa thốt nốt.
1. Tính chất vật lý: Là chất rắn kết tinh, không màu, không mùi, có vị ngọt, tan tốt trong nước.
2. Cấu trúc phân tử
- Saccarozơ là một đisaccarit được cấu tạo từ một gốc ∝-glucozơ và một gốc β-fructozơ LK với nhau qua nguyên tử oxi.
- Trong ptử saccarozơ có nhiều nhóm OH và không có nhóm chức CHO.
3. Tính chất hóa học:
- Có tính chất của ancol đa chức và có phản ứng thủy phân.
- Phân tử không có nhóm –CHO nên không có tính chất của anđehit
a. Phản ứng với Cu(OH)2 → dd màu xanh (to thường)
b. Phản ứng thủy phân: (môi trường axit, xt enzim)
C12H22O11 + H2O \(\xrightarrow{{{H}^{+}},{{t}^{o}}}\) C6H12O6 + C6H12O6.
Saccarozơ glucozơ fructozơ
4. Sản xuất và ứng dụng.
a. Sản xuất: Từ cây mía, củ cải đường, hoa thốt nốt.
(quy trình sản xuất: lưu ý SO2 dùng để tẩy trắng đường).
b. Ứng dụng:
- Làm đường ăn, làm nguyên liệu quan trọng trong công nghiệp thực phẩm, ...
- Dùng để pha chế một số thuốc trong dược phẩm.
* MANTOZƠ: đồng phân của saccarozơ. (đọc thêm)
Cấu tạo của mantozơ gồm 2 gốc α–glucozơ. Trong ptử có nhiều nhóm OH và có chứa chức CHO nên mantozơ có tính chất tương tự glucozơ, nhưng có thêm phản ứng thủy phân.
IV. TINH BỘT: (C6H10O5)n
1. Tính chất vật lý:
- Là chất rắn dạng bột vô định hình, không tan trong nước lạnh.
- Dung dịch tinh bột gọi là hồ tinh bột.
2. Cấu trúc phân tử:
- CTPT (C6H10O5)n gồm nhiều mắc xích ∝–glucozơ liên kết với nhau tạo thành 2 dạng: amilozơ (không nhánh) và amilopectin (có nhánh).
- TB được tạo thành trong cây xanh nhờ quá trình quang hợp.
6nCO2 + 5nH2O \(\xrightarrow{{{H}_{2}}O,as,clorophin}\) (C6H10O5)n + 6nO2
3. Tính chất hóa học
a. Phản ứng thủy phân:
(C6H10O5)n + nH2O \(\xrightarrow{{{H}^{+}},{{t}^{o}}}\) nC6H12O6
b. Phản ứng tạo màu với iot:
TB + iot → hợp chất màu xanh tím (nhận biết)
V. XENLULOZƠ: (C6H10O5)n
1. Tính chất vật lý, trạng thái tự nhiên
- Là chất rắn dạng sợi, màu trắng, không có mùi vị và không tan trong nước.
- Là thành phần chính tạo nên màng tế bào thực vật.
2. Cấu trúc phân tử
CTPT (C6H10O5)n hay [C6H7O2(OH)3]n gồm nhiều mắc xích β–glucozơ liên kết với nhau tạo thành mạch không phân nhánh có khối lượng phân tử rất lớn.
3. Tính chất hóa học
a. Phản ứng thủy phân:
(C6H10O5)n + nH2O \(\xrightarrow{{{H}^{+}},{{t}^{o}}}\) nC6H12O6
b. Phản ứng với axit nitric:
[C6H7O2(OH)3]n +3nHNO3(đặc) \(\xrightarrow{{{H}_{2}}S{{O}_{4}},{{t}^{o}}}\) [C6H7O2(ONO2)3]n + 3nH2O
thuốc súng không khói
4. Ứng dụng: Kéo sợi dệt vải, giấy, tơ nhân tạo tơ visco, tơ axetat.
TỔNG KẾT
A. AMINCHƯƠNG 3: AMIN – AMINOAXIT – PEPTIT
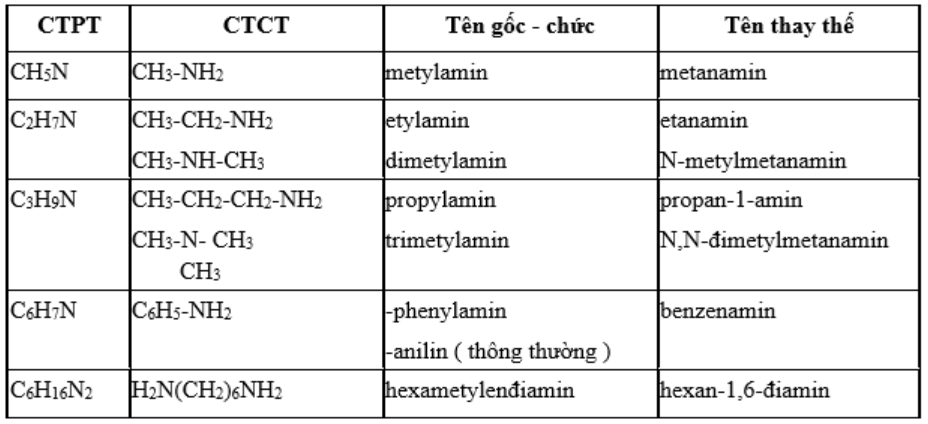
I. KHÁI NIỆM, CÔNG THỨC, PHÂN LOẠI, ĐỒNG PHÂN VÀ DANH PHÁP
1. Khái niệm: Khi thay thế nguyên tử hidro trong phân tử NH3 bằng gốc hiđrocacbon ta được hợp chất amin. Ví dụ: CH3-NH2; CH3- NH-CH3
2. Công thức
a. Amin: CxHyNt điều kiện: 0 < y < 2x + 2 + t và y, t cùng chẳn hoặc cùng lẻ
b. Amin đơn chức: CxHyN điều kiện: 0 < y < 2x + 3
c. Amin no đơn chức, mạch hở : CnH2n+3N ( n ≥ 1)
3. Phân loại
a. Theo gốc hidrocacbon
* amin béo: CH3-NH2
* amin thơm: C6H5-NH2 (anilin)
b. Theo bậc amin:
* amin bậc I: R – NH2
* amin bậc II: R – NH – R’
* amin bậc III:
4. Đồng phân: Amin có đồng phân về mạch cacbon, vị trí nhóm chức, bậc amin. (C2H7N, C3H9N)
5. Danh pháp:
II. TÍNH CHẤT VẬT LÍ:
- Các amin CH3-NH2, (CH3)2-NH, (CH3)3N, C2H5-NH2 là các chất khí, mùi khai, tan nhiều trong nước.
- Anilin C6H5NH2 là chất lỏng, không mùi, ít tan trong nước, nặng hơn nước.
- Các amin đều rất độc
III. TÍNH CHẤT HÓA HỌC: Amin có tính bazơ tương tự NH3
1. Tính bazơ
a. Phản ứng với nước: CH3-NH2 + H2O → [CH3NH3]+ + OH-
* Các amin béo làm quỳ tím hóa xanh (nhận biết amin)
* C6H5NH2 (anilin) không làm đổi màu quỳ tím (do có tính bazơ rất yếu)
b. Phản ứng với axit: CH3-NH2(đặc) + HCl(đặc)→ [CH3NH3]+Cl- ( metyl amoni clorua)
C6H5NH2 HCl → [C6H5NH3]+Cl- ( phenyl amoni clorua)
c. So sánh tính bazơ của các amin:
(Rthơm)3N < (R thơm)2NH < RthơmNH2 < NH3 < Rno NH2 < (Rno)2NH < (Rno)3N
Chú ý: với gốc Rno càng cồng kềnh thì ảnh hưởng không gian của nó càng lớn làm cản trở quá trình H+ tiến lại gần nguyên tử N nên (Rno)2NH < (Rno)3N sẽ không còn đúng nữa.
2. Phản ứng thế ở nhân thơm của anilin (nhận biết anilin)
C6H5-NH2 + 3B2 → C6H2Br3NH2 (↓ trắng) + 3HBr
B. AMINO AXIT
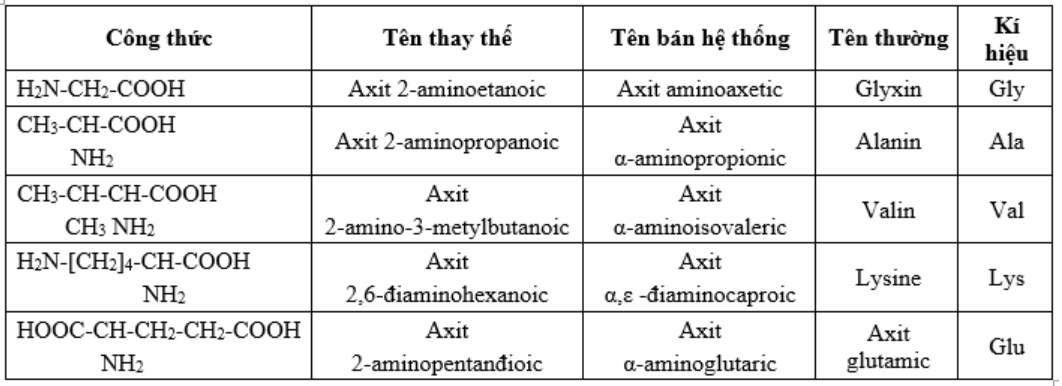
I. KHÁI NIỆM
1. Amino axit là hợp chất hữu cơ tạp chức phân tử có chứa đồng thời nhóm amino (-NH2) và nhóm cacboxyl (-COOH)
2. Công thức: amino axit: R(NH2)n(COOH)m hoặc CxHyOzNt
3. Đồng phân: (C2H5O2N và C3H7O2N)
4. Danh pháp:
II. CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT VẬT LÍ
- Phân tử có nhóm –COOH thể hiện tính axit
- Phân tử có nhóm –NH2 thể hiện tính bazơ
- Có sự tương tác tạo ra ion lưỡng cực:
H2N-R-COOH ↔ H3N+- R – COO-
- Amino axit là những hợp chất ion, ở điều kiện thường là chất rắn kết tinh, dễ tan trong nước.
III. TÍNH CHẤT HÓA HỌC
1. Tính chất lưỡng tính: Phản ứng với axit vô cơ mạnh và bazơ mạnh
HOOC-CH2-NH2 + HCl → HOOC-CH2-NH3Cl
H2N-CH2–COOH + NaOH → H2N–CH2–COONa + H2O
2. Tính axit, bazơ của dung dịch amino axit: R(NH2)n(COOH)m
+ Đối với hợp chất có dạng (NH2)xR(COOH)y
+ nếu x < y → dung dịch có môi trường axit→ quỳ chuyển đỏ
+ nếu x > y → dung dịch có môi trường bazơ→ quỳ chuyển xanh
+ nếu x = y → dung dịch có môi trường trung tính→ không đổi màu quỳ
+ Đối với hợp chất dạng: R(NH3Cl)x(COOH)y(NH2)z(COONa)t
+ Nếu x + y > z + t môi trường axit => quì sang đỏ
+ Nếu x + y < z + t môi trường bazo => quì sang xanh
+ Nếu x + y = z + t môi trường trung tính => không đổi màu quì
3. Phản ứng riêng của nhóm –COOH: phản ứng este hóa
NH2–CH2–COOH + C2H5OH ↔ H2N–CH2–COO-C2H5 + H2O
4. Phản ứng trùng ngưng:
nH2N-[CH2]5–COOH → -(-NH–[CH2]5–CO-)n- + nH2O
axit-ε-aminocaproic policaproamit (tơ capron)
C. PEPTIT VÀ PROTEIN
I. PEPTIT
1. Khái niệm
- Peptit: là loại hợp chất chứa từ 2 đến 50 gốc α-amino axit liên kết với nhau bởi các liên kết peptit
- Liên kết peptit: là liên kết -CO – NH- giữa hai đơn vị α- amino axit
- Nhóm –CO – NH-: được gọi là nhóm peptit
* Phân tử peptit chứa 2 gốc α-amino axit gọi là đipeptit (có 1 liên kết peptit)
* Phân tử peptit chứa 3 gốc α-amino axit gọi là tripeptit (có 2 liên kết peptit)
* Phân tử peptit chứa trên 10 gốc α-amino axit gọi là poli peptit
2. Tính chất hóa học
Phản ứng thủy phân (xt axit hay bazơ) → các α - amino axit.
Phản ứng màu: peptit + Cu(OH)2/NaOH → hợp chất màu tím (phức chất của đồng)
II. PROTEIN
1. Khái niệm: Protein là những polipeptit cao phân tử có phân tử khối từ vài chục nghìn đến vài triệu.
2. Phân loại: 2 loại
Protein đơn giản: khi thủy phân cho hỗn hợp các - amino axit
Protein phức tạp: là loại protein được tạo thành từ prtein đơn giản và phi protein.
3. Tính chất:
Tính chất đông tụ: các protein hình cầu tan được trong nước tạo thành dung dịch keo và đông tụ khi đun nóng.
Vd: Sự đông tụ của lòng trắng trứng khi đun nóng
Phản ứng thủy phân: (xt axit hay bazơ) tạo thành α-amino axit
Protein \(\xrightarrow{xt}\) các chuỗi peptit \(\xrightarrow{xt}\) các α-amino axit
Phản ứng màu với Cu(OH)2/NaOH tạo màu tím đặc trưng để phân biệt protein.
Protein + Cu(OH)2 \(\xrightarrow{O{{H}^{-}}}\) hợp chất màu tím => Phản ứng nhận biết lòng trắng trứng
CHƯƠNG 4: POLIME
I. ĐẠI CƯƠNG POLIME
1. Khái niệm: Polime là hợp chất có phân tử khối lớn do nhiều đơn vị cơ sở gọi là mắt xích liên kết với nhau tạo nên.
Ví dụ: (–CH2-CH2–)n , (–NH[CH2]5–CO–)n
Polietilen Nilon-6
Với: + n là hệ số polime hóa hay độ polime hóa.
+ Các phân tử CH2=CH2, H2N[CH2]5COOH, ... phản ứng với nhau tạo nên polime thì gọi là monome.
+ Tên của polime = poli + tên của monome.
2. Phân loại:
- Polime thiên nhiên: tinh bột, xenlulozơ, cao su, ...
- Polime tổng hợp (được trùng hợp, trùng ngưng): polietilen, cao su buna, 6,6, ...
- Polime bán tổng hợp: tơ visco, tơ axetat, ...
3. Đặc điểm cấu trúc: Polime là những chất phân tử khối cao
- Mạch không nhánh: PE, PVC, xenlulozơ, amilozơ.
- Mạch có nhánh: amilopectin, glicogen, …
- Mạch mạng không gian: CS lưu hóa, nhựa bakelit.
4. Tính chất vật lý: Không bay hơi, không có nhiệt độ nóng chảy cố định, khó hòa tan, cách điện, cách nhiệt, một số có tính dẻo, tính đàn hồi, …
5. Tính chất hóa học: (đọc thêm)
Polime có những pứ phân cắt mạch, giữ nguyên mạch và phát triển mạch cacbon.
6. Phương pháp điều chế:
a. Phản ứng trùng hợp: là quá trình kết hợp nhiều phân tử nhỏ (momome) giống nhau hay tương tự nhau thành ptử lớn (polime).
* Điều kiện: Cấu tạo monome phải có liên kết bội hoặc vòng kém bền.
b. Phản ứng trùng ngưng: là quá trình kết hợp nhiều ptử nhỏ (momome) giống nhau hay tương tự nhau thành ptử lớn (polime) đồng thời giải phóng những ptử nhỏ khác (H2O, HCl, ...).
* Điều kiện: Cấu tạo monome phải có ít nhất 2 nhóm chức có khả năng pứ.
Ví dụ: HOOC-C6H4-COOH; OH-CH2-CH2–OH
II. VẬT LIỆU POLIME
1. Chất dẻo: là những vật liệu polime có tính dẻo (PE, PVC, thủy tinh hữu cơ, PPF)
a) Polietilen. (PE): (-CH2 - CH2-)n
nCH2=CH2 \(\xrightarrow{xt}\) ( CH2 - CH2 )n.
b) Polivinyl clorua. (PVC): (-CH2 – CHCl-)n
c) Poli(metyl metacrylat): thủy tinh hữu cơ plexiglas
d) Poli(phenol-fomanđehit) (PPF)
2. Tơ: Tơ là những vật liệu polime hình sợi dài, bền, có mạch không phân nhánh.
Phân loại:
- Tơ thiên nhiên: bông, sợi, len, lông cừu, tơ tằm, …
- Tơ hóa học: + Tơ tổng hợp: nilon-6,6, capron, nitron hay olon, ...
* Nilon-6,6:
NH2-[CH2]5-NH2 + HOOC-[CH2]4-COOH → (-NH-[CH2]5-NH-OC-[CH2]4-CO-)n + 2nH2O
Hexametylenđiamin axit ađipic (thuộc loại tơ poliamit)
* Nilon-7: tơ enang.
NH2-[CH2]6-COOH → (-NH-[CH2]6 –CO-)n + H2O
* Tơ nitron hay tơ olon:
nCH2=CHCN \(\xrightarrow{ROOR,{{t}^{0}}}\) ( CH2 - CHCN )n
acrilonitrin poli(acrilonitrin)
+ Tơ bán tổng hợp: visco, xenlulozơ axetat, ...
3. Cao su: Cao su là loại vật liệu polime có tính đàn hồi.
Phân loại:
- Cao su thiên nhiên: (C5H8)n có tên poliisopren
- Cao su tổng hợp: Cao su buna, cao su buna-S, cao su buna-N
4. Vật liệu compozit: là vật liệu hỗn hợp gồm ít nhất hai thành phần phân tán vào nhau mà không tan vào nhau.
5. Keo dán tổng hợp (đọc thêm): Keo dán là loại vật liệu có khả năng kết dính mà không làm biến đổi bản chất hóa học. Vd: Nhựa vá săm, keo dán epoxi, keo dán ure-fomanđehit.
CHƯƠNG 5: ĐẠI CƯƠNG KIM LOẠI
1. Tính chất vật lý
- Khối lượng riêng: Os lớn nhất, Li nhỏ nhất
- Nhiệt độ nóng chảy: W lớn nhất, Hg nhỏ nhất
- Tính cứng: Cr cứng nhất, Cs nhỏ nhất
Tính chất hóa học: Tính khử:
- Tác dụng với phi kim:
3Fe + 2O2 \(\xrightarrow{{{t}^{{}^\circ }}}\) Fe3O4 (FeO.Fe2O3) | |
2Fe + 3Cl2 \(\xrightarrow{{{t}^{{}^\circ }}}\) 2FeCl3 2Fe + 3Br2 \(\xrightarrow{{{t}^{{}^\circ }}}\) 2FeBr3 | |
- Tác dụng với axit:
+) H2SO4 loãng, HCl + kim loại trước H → H2↑ + muối (kim loại có hóa trị thấp)
+) H2SO4 đặc nóng, HNO3 + hầu hết các kim loại ( trừ Au,Pt) tạo muối (kim loại có hóa trị cao) + sản phẩm khử + H2O
3Cu + 8HNO3(l) \(\xrightarrow{{}}\)3Cu(NO3)2 + 2NO↑ + 4H2O
\(2\overset{0}{\mathop{Fe}}\,+6{{H}_{2}}S{{O}_{4}}\xrightarrow{{{t}^{{}^\circ }}}\overset{+3}{\mathop{Fe}}\,{{}_{2}}{{(S{{O}_{4}})}_{3}}+3S{{O}_{2}}+6{{H}_{2}}O\)
* Fe, Al, Cr thụ động (không phản ứng) với HNO3 đặc nguội, H2SO4 đặc nguội
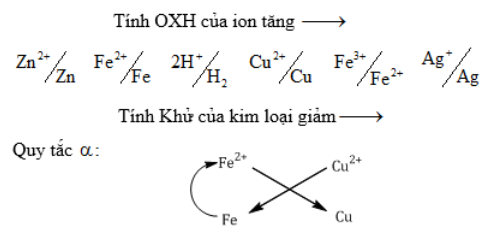
2. Dãy điện hóa:
* Tác dụng với\(\overset{+1}{\mathop{H}}\,{{}_{2}}O\): Kim loại kiềm, Ca, Ba, Sr (t0 thường)
Na + H2O \(\xrightarrow{{}}\) NaOH + H2↑
Ba + 2H2O \(\xrightarrow{{}}\) Ba(OH)2 + H2↑
Điều chế kim loại:
\(\underbrace{K,Na,Ca,Mg}_{(1)},\underbrace{Al}_{(2)},\underbrace{Zn,Fe,Ni,Sn,Pb,H,Cu,Hg,Ag,Pt,Au}_{(3)}\)
(1): Điện phân nóng chảy: \(MC{{l}_{n}}\xrightarrow{dpnc}M+\frac{n}{2}C{{l}_{2}}\)
(2): Điện phân nóng chảy: \(2A{{l}_{2}}{{O}_{3}}\xrightarrow[N{{a}_{3}}Al{{F}_{6}}]{dpnc}4Al+3{{O}_{2}}\)
(3): Điện phân dung dịch, thủy luyện, nhiệt luyện
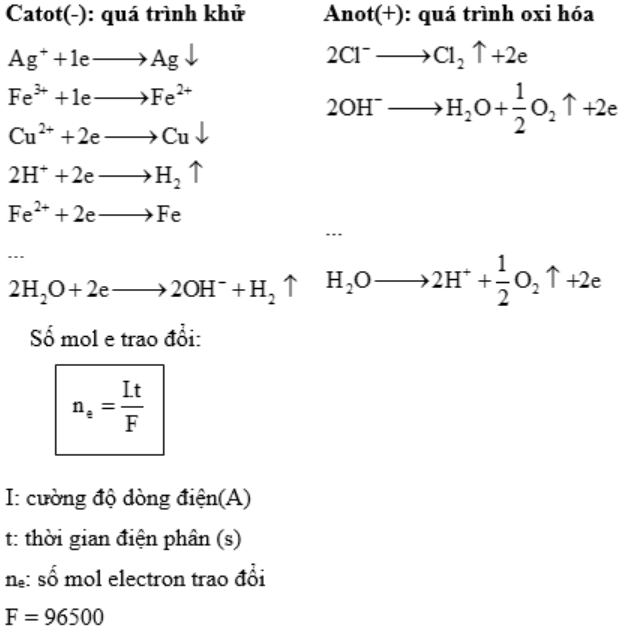
Điện phân dung dịch:
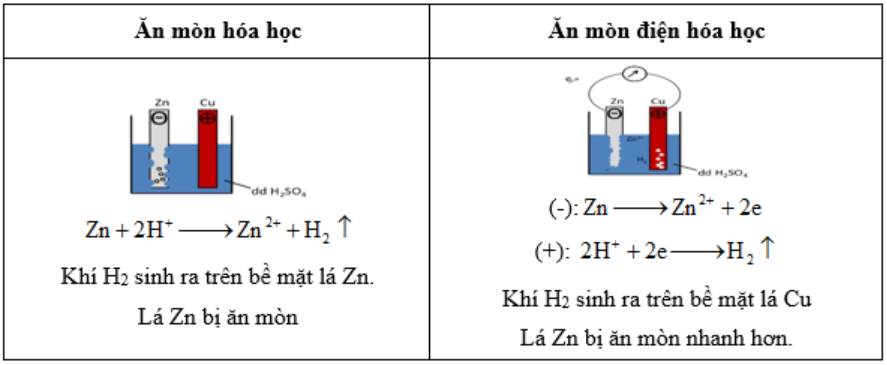
Ăn mòn kim loại:
Ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi trường (quá trình OXH – Khử)
Điều kiện xảy ra ăn mòn điện hóa học:
- Các điện cực khác nhau về bản chất.
- Các điện cực tiếp xúc trực tiếp hoặc gián tiếp.
- Các điện cực cùng tiếp xúc với dung dịch điện ly.
Bảo vệ kim loại:
- Phương pháp bảo vệ bề mặt: sơn, mạ, bôi dầu mỡ…
- Phương pháp điện hóa: dùng kim loại mạnh hơn làm vật hi sinh ví dụ: dùng Zn bảo vệ Fe.
Gợi ý sách
CHƯƠNG 9. QUẦN XÃ SINH VẬT
HÌNH HỌC SBT - TOÁN 12 NÂNG CAO
Unit 11. Books
Bài giảng ôn luyện kiến thức giữa học kì 2 môn Vật lí lớp 12
Bài giảng ôn luyện kiến thức giữa học kì 1 môn Sinh học lớp 12